Biofilm jest powszechnie występującym zjawiskiem w wielu środowiskach. Jego obecność może prowadzić do poważnych problemów, zwłaszcza w sektorze medycznym, przemysłowym i spożywczym. Tradycyjne metody dezynfekcji często zawodzą w usuwaniu biofilmu, co zwiększa ryzyko infekcji i kontaminacji.
W odpowiedzi na te wyzwania, naukowcy i specjaliści opracowują nowe technologie, które skutecznie eliminują biofilm i minimalizują związane z nim zagrożenia. W niniejszym artykule przybliżymy naturę biofilmu, wyjaśnimy mechanizmy jego powstawania i trudności związane z jego usuwaniem. Omówimy również najnowsze osiągnięcia technologiczne, takie jak promieniowanie UV 222 nm i zastosowanie kwasu podchlorawego, które rewolucjonizują podejście do dezynfekcji i dekontaminacji.
Spis treści:
Biofilm – co to jest? W jaki sposób powstaje?
Biofilm to złożona struktura wielokomórkowa, którą tworzą mikroorganizmy osadzające się na różnych rodzajach powierzchni, zarówno biotycznych (np. tkanki), jak i abiotycznych (np. metal, plastik, szkło). Struktura ta składa się z mikroorganizmów otoczonych własną macierzą pozakomórkową, która przyczepia się do różnych powierzchni. Mikroorganizmy w biofilmie mogą obejmować bakterie, grzyby, a nawet algi, które tworzą zwartą i trudno usuwalną warstwę.
Powstawanie biofilmu jest procesem wieloetapowym, który obejmuje adhezję początkową – mikroorganizmy przyczepiają się do powierzchni za pomocą sił fizycznych i chemicznych; adhezję nieodwracalną, podczas której wydzielane są substancje adhezyjne stabilizujące połączenie mikroorganizmów z powierzchnią.
Następnie mikroorganizmy formują mikrokolonie, dzielą się i tworzą struktury o wysokiej gęstości komórkowej. Gdy natomiast biofilm osiąga pełną dojrzałość, część mikroorganizmów może odłączać się od niego, aby zasiedlać nowe powierzchnie.
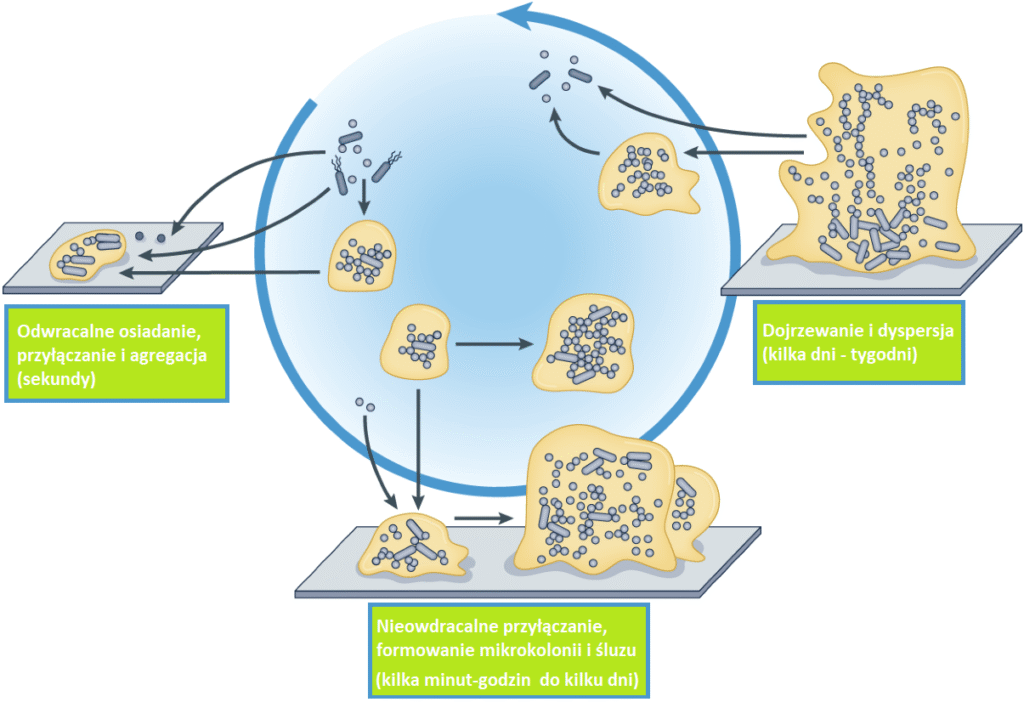
Źródło: Karin Sauer et.al. "The biofilm life cycle: expanding the conceptual model of biofilm formation"; Nature Reviews Microbiology volume 20, pages 608–620 (2022)
Quorum Sensing – elektrochemiczna komunikacja drobnoustrojów
Biofilm może być strukturą wielogatunkową, co znaczy że mikroorganizmy w nim zawarte mogą być całkowicie innych genotypów, gatunków czy rodzin. Potrafią one jednak żyć ze sobą w symbiozie, tworząc wspólne i wspierające środowisko. Co istotne, w biofilmie dochodzi do zjawiska nazwanego „quorum sensing” – jest to sposób międzygatunkowego „porozumiewania się” ze sobą mikroorganizmów za pomocą sygnałów elektro-chemicznych lub cząsteczek sygnałowych zwanych autoinduktorami, które umożliwiają szybką i efektywną reakcję całych kolonii w celu osiągnięcia wzajemnych korzyści, takich jak: wytwarzanie większej ilości ochronnego śluzu, dzielnie się genami lekooporności, wspólne namnażanie, tworzenie odpowiedniego pH środowiska. Quorum Sensing jest dosyć niedawno odkrytą i niepozorną cechą, która dotyczy jednak na wielu najważniejszych czynników wpływających na wysoką odporność biofilmu. Idealne metody dezynfekcyjne powinny zakłócać Quorum Sensing biofilmu lub niszczyć autoinduktory, efektywnie penetrować biofilm w głąb struktur komórkowych oraz oddziaływać na wszystkie podgatunki patogenów, które w nim się znajdują.
Rosnąca lekooporność mikroorganizmów
Oporność na środki przeciwdrobnoustrojowe występuje, gdy mikroorganizmy, takie jak bakterie, grzyby, wirusy i pasożyty, ewoluują, aby oprzeć się działaniu leków. Ta oporność sprawia, że standardowe metody leczenia są nieskuteczne, a zakażenia trudniejsze do kontrolowania. Prowadzi to do wyższych kosztów leczenia, dłuższego pobytu w szpitalu i zwiększonej śmiertelności. Taka szeroka oporność może rozwinąć się w wyniku nadużywania i niewłaściwego stosowania tych leków w medycynie ludzkiej oraz w sektorach weterynaryjnym i rolniczym. Nieselektywne stosowanie antybiotyków i odpowiednich substancji przeciwdrobnoustrojowych pozwala patogenom przetrwać, ewoluować i ostatecznie oprzeć się nowym kontaktom z lekami.
Candida auris jako super-patogen
Jednym z super-patogenów tworzących biofilm, który wzbudza obawy medyków i może potencjalnie wywołać w przyszłości poważną epidemię jest candida auris – pospolity drożdżak, który uodpornił się na powszechne leki przeciwgrzybicze. Aktualnie candida auris atakuje głównie osoby z bardzo obniżoną odpornością, lecz jej problem staje się coraz powszechniejszy.
Antybiotykooporność
Oporność na antybiotyki jest podzbiorem lekooporności i prawdopodobnie najbardziej znanym typem, obejmującym głównie bakterie. Kiedy bakterie stają się oporne na antybiotyki, to nawet małe i wcześniej niegroźne zakażenia stają się trudniejsze, a czasem nawet niemożliwe do wyleczenia, prowadząc do poważnych skutków zdrowotnych takich jak zapalenie płuc, gruźlica i salmonelloza. Rosnąca oporność nie tylko sprawia, że zakażenia bakteryjne są bardziej niebezpieczne, ale zwiększa się także ryzyko rozprzestrzeniania się opornych bakterii oraz przekazywania tej oporności na inne gatunki, co dzieje się na kilka różnych sposobów.
Super-bakteria New Delhi
Enzym NDM-1 (skrót od ang. New Delhi metallo-β-lactamase) – to enzym z grupy metalo-β-laktamaz nadający oporność bakteriom na wiele antybiotyków beta-laktamowych. Dotyczy to również karbapenemów, które używane były głównie do leczenia chorób powodowanych przez bakterie oporne na inne antybiotyki. Umiejętność wytwarzania tego enzymu przez bakterie stała się główną przyczyną antybiotykoodporności, a jej rosnąca powszechność związana jest z możliwością przekazywania umiejętności produkcji enzymu NDM-1 międzygatunkowo innym bakteriom poprzez transfer poziomy genów.
Czy biofilm stanowi zagrożenie dla zdrowia ludzkiego?
Biofilm jest poważnym zagrożeniem dla zdrowia ludzkiego, szczególnie w kontekście opieki medycznej i zdrowia publicznego. Różne rodzaje i gatunki patogenów w biofilmie powodują często złożone koinfekcje (infekcje wywołane równocześnie zarówno przez wirusy, jak i bakterie i grzyby), co utrudnia lub nawet uniemożliwia skuteczne leczenie zakażeń i sprzyja ich przewlekłemu przebiegowi.
W szpitalach biofilmy rozwijają się na sprzęcie medycznym, takim jak cewniki, sztuczne zastawki serca, protezy ortopedyczne i implanty, stając się główną przyczyną zakażeń szpitalnych, które są często oporne na standardowe leczenie. Infekcje te mogą prowadzić do poważnych powikłań, takich jak posocznica, zapalenie wsierdzia czy zapalenie płuc, szczególnie u pacjentów z obniżoną odpornością. W przypadku, gdy biofilm wbuduje się w głąb tkanki, to jego leczenie staje się bardzo trudne i czasochłonne.
W przemyśle spożywczym, biofilmy mogą zanieczyszczać powierzchnie kontaktujące się z żywnością, co prowadzi do rozprzestrzeniania się patogenów, takich jak Listeria monocytogenes czy Salmonella, powodując ogniska zatruć pokarmowych. W efekcie, obecność biofilmu nie tylko zwiększa ryzyko infekcji, ale również przyczynia się do strat ekonomicznych, związanych z koniecznością wycofywania partii ze sprzedaży, wdrażania bardziej zaawansowanych metod dezynfekcji, czy stosowania bardziej agresywnej chemiil, która skutkuje niszczeniem i częstszą wymiany sprzętu oraz skażeniem produktów żywnościowych.
Biofilm a dezynfekcja
Podstawowym celem dezynfekcji jest eliminacja biofilmu oraz mikroorganizmów, które mogą stanowić zagrożenie dla zdrowia ludzkiego. Jednym z głównych wyzwań związanych z biofilmem jest jego wyjątkowa odporność na klasyczne metody dezynfekcji.
Biofilm charakteryzuje się znacznie większą odpornością na działanie środków dezynfekujących — komórki w biofilmie mogą być nawet tysiąc razy bardziej odporne niż te, które nie tworzą takiej struktury. Jednocześnie warto podkreślić, że im starszy jest biofilm, tym trudniej go usunąć.
Wyróżnia się kilka kluczowych powodów, dla których biofilm jest trudny do usunięcia. Przede wszystkim, macierz pozakomórkowa działa niczym tarcza ochronna, blokując dostęp środków dezynfekcyjnych do komórek wewnętrznych. Po drugie, w biofilmie występują zróżnicowane warunki mikrośrodowiskowe, co prowadzi do zmniejszonej skuteczności środków chemicznych. Ponadto mikroorganizmy w biofilmie mogą przyjmować różne fenotypy, w tym formy przetrwalnikowe, które są mniej podatne na działanie antybiotyków i biocydów.
Biofilm, z uwagi na swoją złożoną strukturę, stanowi poważne wyzwanie dla tradycyjnych metod dezynfekcji. Jego obecność na powierzchniach, zarówno w środowiskach medycznych, jak i przemysłowych, może znacznie obniżyć skuteczność standardowych procedur czyszczenia i dekontaminacji. Kluczową trudnością jest to, że mikroorganizmy tworzące biofilm są osadzone w gęstej macierzy pozakomórkowej, która działa jak bariera ochronna. Ta struktura chroni bakterie przed działaniem zarówno chemicznych, jak i fizycznych środków dezynfekcyjnych, uniemożliwiając pełny kontakt z mikroorganizmami wewnątrz biofilmu.
Walka z biofilmem wymaga zastosowania bardziej zaawansowanych i specjalistycznych metod dezynfekcji. Często konieczne jest łączenie różnych technik, czy wykorzystanie bardziej innowacyjnych technologii, które mogą penetrować biofilm i skutecznie eliminować jego składniki. Dlatego, aby skutecznie radzić sobie z biofilmami, konieczne jest stosowanie wieloetapowego podejścia do dezynfekcji, które uwzględnia zarówno usunięcie samego biofilmu, jak i eliminację mikroorganizmów osadzonych w jego wnętrzu.
Najczęstsze błędy prowadzące do powstawania opornego biofilmu:
- Dezynfekowanie zanieczyszczonych powierzchni
Zniszczenie tylko zewnętrznej warstwy biofilmu, powoduje że głębsze warstwy zaczynają przejmować nowe funkcje organiczne i wytwarzają większą ilość śluzu, który jeszcze lepiej chroni biofilm. - Generowanie bioaerozolu myjkami ciśnieniowymi
Podczas mycia ciśnieniowego sprzętów, podłóg, odpływów itp., do powietrza dostają się szkodliwe drobnoustroje, z którym łatwo przenoszą się do innych obszarów. Mikroorganizmy krążą w powietrzu przez jakiś czas i następnie osiadają na świeżo zdezynfekowanych powierzchniach, gdzie na nowo odtwarzają kolonie. - Pomijanie lub niedokładne mycie sprzętu mobilnego
Niedomywanie zakamarków, szczelin, osłon nad kołami oraz miejsc trudnodostępnych jest jedną z głównym przyczyn szybkiego skażenia wtórnego i roznoszenia biofilmu. - Pomijanie lub niedokładne mycie i dezynfekcja urządzeń chłodniczych oraz kanałów wentylacyjnych. W związku z obecną wilgocią mogą być źródłem bakterii, grzybów i pleśni.
- Nieodpowiednie stosowanie i złe dobieranie środków do dezynfekcji
Niestosowanie się zaleceń producenta odnośnie niezbędnego czasu kontaktu, stężenia i ilości środka dezynfekcyjnego prowadzi do rozwoju oporności mikroorganizmów, tworząc coraz groźniejsze i trudniejsze do usunięcia patogeny.
Nowoczesne metody wykrywania i usuwania biofilmu
Biofilm, zanim osiągnie swoją dojrzałą postać, jest praktycznie niewidoczny gołym okiem. Do skutecznego wykrywania mikroorganizmów został zaprojektowany detektor substancji organicznych CiFi Torch mający postać poręcznej latarki oraz okularów polaryzacyjnych, którem umożliwiają podświetlenie i uwidocznienie materiału organicznego, w tym m. in. biofilmu. Urządzenie umożliwia wykrywanie niewidocznych dla oka źródeł patogenów biologicznych za pomocą światła wysokiej intensywności o długości fali 445 nm.

Z kolei w odpowiedzi na wyzwania związane z biofilmami, nauka i technologia rozwijają nowe metody ich eliminacji, w tym m. in.:
UV 222nm jest niezwykle obiecującą metodą dezynfekcji. Jest bardzo skuteczna w niszczeniu mikroorganizmów, jednocześnie pozostając bezpieczną dla ludzi. Promieniowanie uszkadza DNA i RNA mikroorganizmów. Zastosowanie lamp UV 222nm pozwala bardzo szybko dezynfekować powietrze i powierzchnie, skutecznie eliminując z nich bakterie, wirusy i grzyby, zapobiegając narastaniu biofilmu na oświetlonych powierzchniach.
Kwas podchlorawy (HOCI) jest silnym środkiem biobójczym, które działa poprzez utlenianie komponentów komórkowych mikroorganizmów. Jest szczególnie skuteczny w niszczeniu biofilmów, ponieważ potrafi dotrzeć do komórek bakterii. Jednocześnie jest bezpieczny dla skóry i błon śluzowych, co czyni go doskonałym środkiem dezynfekcji w środowisku medycznym oraz spożywczym.
Kwas podchlorawy wykazuje szybkie działanie dezynfekcyjne oraz posiada udowodnione naukowo pełne spektrum biobójcze wobec wszystkich mikroorganizmów. Ponadto wykazuje skuteczną penetrację i niszczenie biofilmu oraz ma dosyć dobre własności myjące, co stawia go w bardzo dobrej pozycji jako uniwersalny środek do wielu zastosowań.
Procedura skutecznej eliminacji biofilmu oraz sporów na powierzchniach i w zakamarkach za pomocą kwasu podchlorawego BMAsept:

Zabezpieczanie powierzchni wielodotykowych polega na powlekaniu powierzchni specjalną powłoką, która zmniejsza ryzyko ich kontaminacji, a także zabezpiecza przed odtwarzaniem się biofilmu, tworząc podłoże, które nie jest możliwe do skolonizowania przez mikroorganizmy.
Środki biobójcze o przedłużonym działaniu – wykazują szerokie spektrum działania na mikroorganizmy, a jednocześnie hamują tworzenie biofilmu. Ich zastosowanie zapewnia wydłużoną w czasie ochronę powierzchni. Blokowanie aktywności systemów Quorum Sensing przy użyciu nanomateriałów, zwłaszcza nanocząsteczek metali, to skuteczna strategia wykorzystywana w walce z drobnoustrojami chorobotwórczymi. Nowoczesne metody biotechnologiczne umożliwiają syntezę nanocząsteczek, które wykazują wysoką specyficzność względem systemów Quorum Sensing i ich autoinduktorów. Już od dawna wskazuje się na istotną rolę jonów srebra i miedzi w leczeniu infekcji bakteryjnych, ponieważ wchłaniają się w głąb biofilmu, niszczą błony komórkowe i zatrzymują procesy życiowe mikroorganizmów. Jednakże, jony srebra czy miedzi bardzo szybko ulegają inaktywacji, co stanowi istotne ograniczenie ich wykorzystywania jako długotrwałego środka antybakteryjnego. Dlatego też coraz większe znaczenie w terapii zakażeń bakteryjnych i grzybiczych przypisuje się nanocząsteczkom miedzi i srebra niejonowego, np. takiego jak cząstki opatentowane aXonnite, których wodny koloid zarejestrowany jest jako substancja biobójcza i posiada wykazuje przedłużone działanie bójcze, prowadzące do stale obecnej na powierzchniach dezynfekcji, czyli tzw. Ciągłej Aktywnej Dezynfekcji.
Biofilm: czas na nowoczesne technologie
Biofilm to jeden z najtrudniejszych do pokonania problemów współczesnej medycyny, przemysłu i ochrony zdrowia publicznego. Jego zdolność do ochrony mikroorganizmów przed działaniem środków dezynfekcyjnych, jak również zwiększona oporność na antybiotyki, sprawiają, że stanowi poważne zagrożenie w kontekście zakażeń szpitalnych, skażenia wody pitnej czy kontaminacji powierzchni w przemyśle spożywczym. Tworzenie się biofilmu jest procesem dynamicznym, w którym mikroorganizmy przekształcają się w trudne do zniszczenia struktury, które mogą wytrwać w ekstremalnych warunkach.
Skuteczne usuwanie biofilmu wymaga nowoczesnych technologii, które potrafią przełamać naturalne bariery ochronne mikroorganizmów. Choć wyzwania związane z biofilmem są duże, to rozwój innowacyjnych metod dezynfekcji daje nadzieję na ich skuteczne pokonanie nawet super-patogenów. Aby zapewnić bezpieczeństwo zdrowia publicznego i efektywnie chronić powierzchnie medyczne i przemysłowe, konieczne jest stosowanie zaawansowanych i skoordynowanych strategii, które umożliwią usunięcie biofilmu w sposób kompleksowy i trwały.
W kontekście rosnącej oporności mikroorganizmów na tradycyjne środki dezynfekcyjne, walka z biofilmem staje się jednym z kluczowych wyzwań współczesnej nauki i technologii, które nie tylko zmieniają podejście do higieny, ale także pomagają w minimalizacji ryzyka infekcji i poprawie jakości życia ludzi na całym świecie.
Bibliografia:
United Nations Environment Programme (2023). “Bracing for Superbugs: Strengthening environmental action in the One Health response to antimicrobial resistance”. ISBN: 978-92-807-4006-6, Geneva,
WHO Bacterial Priority Pathogens List, (2024): Bacterial pathogens of public health importance to guide research, development and strategies to prevent and control antimicrobial resistance ISBN 978-92-4-009346-1 (electronic version) ISBN 978-92-4-009347-8 (print version)
Paulina Lipa, Marta Kozieł, Monika Janczarek, Postępy Biochemii, Tom 63 Nr 4 (2017): „Zjawisko Quorum Sensing bakterii Gram-ujemnych: cząsteczki sygnałowe i inhibitory oraz ich potencjalne zastosowanie terapeutyczne”
Singh BR, Singh BN, Singh A, Khan W, Naqvi AH, Singh HB (2015) Mycofabricated biosilver nanoparticles interrupt Pseudomonas aerugi nosa quorum sensing systems. Sci Reports 5: 13719 149.
Radzig MA, Nadtochenko VA, Koksharova OA, Kiwi J, Lipasova VA, Khmel IA (2013) Antibacterial effects of silver nanoparticles n gram-negative bacteria: influence on the growth and biofilms for mation, mechanisms of action. Colloid Surfuce B: Biointerfaces 102: 300-306
